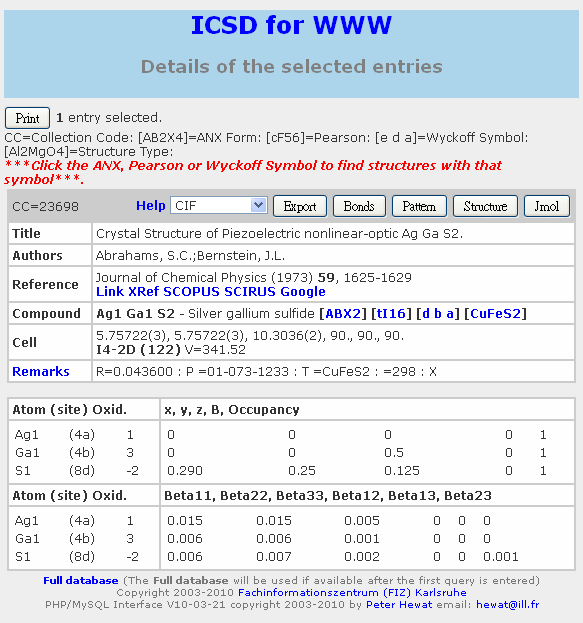
四、AgGaS2 是一個會吸收藍光、不吸收其他色光而呈透明淡黃色的晶體。試利用選原子的投影態密度作圖,排序三個元素位在能隙的兩邊的的態密度投影貢獻度,其即為最可能決定晶體顏色的元素物種。
http://www.altechna.com/product_details.php?id=264
計算材料期中考 2013
(每題二十分)
原子分子
(Why is Cl2 and F2 single bonded ? Compare O=O and N≡N. Also, what is the bond order of C2 ? and what is the bond order of P2 ?)
一、分別以 C2H6 及 C2H4 之 C-C 鍵級 作為單鍵及雙鍵的標準,估計 H2, He2, Li2, Be2, B2, C2, N2, O2, F2, Xe2 的鍵級。
二、預測 CO2、HCN、XeF2、BCl2 線狀分子,並顯示其 π 分子軌域。另外,驗證 NH3 及BCl3 ,一個是平面分子,另一個不是,並指出那一個分子帶有孤立電子對,將之顯示出來。
(備用題)二(a)、以 orbital density 說明 乙炔分子 C2H2 (H-C≡C-H) 的碳-碳三鍵,是由一個 σ 及兩個 π 鍵所構成。
(備用題)二(b)、分別計算順磁態 (電子自旋 7 up : 5 down) 及反磁態 (電子自旋 6 up : 6 down) 之氧分子 O2 的總能,證明總能較低的是順磁態者。(提醒:我們現在不知道兩個氧原子的距離,因此要先用不縮放晶胞大小的幾何結構最佳化。)
形成能
三、比較 鈉金屬、氯分子,以及氯化鈉,以求出下 4 Na + 2 Cl2 → 4 NaCl 反應熱 ΔE = E( 4NaCl ) - [ 2 E( 2Na ) + 2 E( Cl2 ) ] 的正負,以判斷是鈉金屬、氯氣較穩定,抑或是氯化鈉離子晶體較穩定。
(備用題)三(a)、計算氧分子 O2 的鍵能(注意氧分子的基態是順磁性,因此要打開電子自旋)。
能帶結構
以一倍及 x 方向兩倍的金屬鋁 fcc 晶胞來
投影態密度
四、AgGaS2 是一個會吸收藍光、不吸收其他色光而呈透明淡黃色的晶體。試利用選原子的投影態密度作圖,排序三個元素位在能隙的兩邊的的態密度投影貢獻度,其即為最可能決定晶體顏色的元素物種。
http://www.altechna.com/product_details.php?id=264
磁性
五、計算金屬鎳的自旋能帶結構,並預測其自發磁化率。