熱平衡的系統
系統:我們要研究的宇宙的一部分
熱平衡: 巨觀量不再隨時間改變
狀態函數
狀態 :(各)巨觀的可觀量與演變的歷程 (或路徑) 無關
狀態 (v.2):與歷程 (或路徑) 無關的物性
我們下面將會具體說明 為何功與熱都不是狀態
狀態函數:該可觀量 (描述狀態的自變數),在系統平衡後,與時間無關。
狀態函數:有那些?(溫度、壓力)
問題思考
兩個系統有某個狀態函數一樣,有什麼意義?
兩個系統有很多個狀態函數一樣,有什麼意義?
兩個系統所有狀態函數都一樣,有什麼意義?
狀態函數是有限個還是無限個?
回答了上述問題,又到底有什麼意義?
以下什麼比較接近狀態函數?
姓名?八字?學歷?年齡?(FB)感情狀態?
時間是微觀量還是巨觀量?
那空間呢?
定義狀態函數的目的:描繪能量
例如,層架上的花瓶與位能(只有高度的不同,其他沒任何相異,低層落下沒事而高層落下則摔破)。
狀態函數的用法
描述系統
狀態函數的數學處理
描述狀態的一組參數 x = ( x1, x2, ... ) ,構成狀態函數 f(x) (注意這些描述系統的參數本身也是狀態函數,是我們之後想要組合出各種更複雜的狀態函數,才用 f(x) )
此一系統的參數從 xi 變化至 xf
Δf = ∫xixf df = f(xf) - f(xi)
Ex 1.1 三條不同路徑的函數積分值 (見下圖)
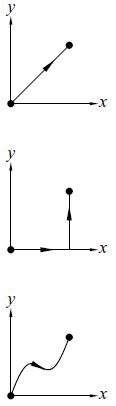
系統 由 x 與 y 兩個狀態函數描述
假設 f = x y
則 df = x dy + y dx
Δf = xy |xfxi=> 只跟初態與末態函數值有關。
另外假設 dg = y dx ( dg 是一個 inexact differential)
則 Δg = ∫ ... ...
見 (11.4)、(11.5) 式,已可見不同(不用再看第三種路徑了) 。
對於微小變化
d U = δQ + δW
或
d U = đ Q +đ W
其中đ Q 和 đ W 都不是 exact differential,也就是 inexact differential
(為什麼?) (Hint:功、熱都是能,而能量守恆。)
đW ≡ f dx
因此對氣體,有
đW = - p dV
其中負號來自 "定" 對氣體系統 "壓縮" 是作 "正功" ,由以上形式,如此足見功不是狀態函數。
思考:熱力學方程式中所出現的量,是狀態函數或不是,有什麼重要性嗎?
我們現在想更深入了解,加入熱是如何改變 "氣體的" 內能。
我們將會看到,從第一定律的框架下,定容比熱與定壓比熱的關係。
作法:dQ = dU + p dV 已知,再代入 dU 與 T、V 的關係,使我們可得 dQ 與 dT、dV 的關係。
對氣體,一般 (in general) 而言,U = U(T, V)
(為什麼這句話是對的?不可以再有更多其他的自變數嗎?) (試回憶理想氣體方程式,總共也才幾個獨立變數而已。)
諸多偏微分關係,詳見課本 . . .
dU = (∂U / ∂T )V dT + (∂U / ∂V )T dV
由前面的 dU = d Q + d W 又 dW = - p dV,則
dQ = dU + p dV
將上式 dU 的完整偏微分形式代入其中,並同除以 dT,得
dQ / dT = (∂U / ∂T )V + [ (∂U / ∂V )T + p ] ( dV / dT )
之前曾定義
CV ≡ (∂Q / ∂T )V
則基於上面 dQ / dT 形式,第二項無貢獻,故有
CV = (∂U / ∂T )V
至於 Cp 則為
Cp ≡ (∂Q / ∂T )p
= { (∂U / ∂T )V + [ (∂U / ∂V )T + p ] ( dV / dT ) }p
= (∂U / ∂T )V + [ (∂U / ∂V )T + p ] ( ∂V / ∂T )p
= CV + [ (∂U / ∂V )T + p ] ( ∂V / ∂T )p
Cp- CV = [ (∂U / ∂V )T + p ] ( ∂V / ∂T )p
我們有時希望描述每莫耳熱容或單位質量熱容,故定比熱
cV = CV / M
cp = Cp / M
Ex 11.2 理想單原子氣體的熱容
每莫耳理想單原子氣體 U = 3/2 RT ,只與溫度有關,故
( ∂U / ∂V )T = 0
再用上了每莫耳分子 pV = RT
,即 V = RT/p ,故
( ∂V / ∂T )p = R/p
由前有之 Cp- CV = [ (∂U / ∂V )T + p ] ( ∂V / ∂T )p = [ 0 + p ] R/p = R
再由 U = 3/2 RT ,而有 CV = (∂U / ∂T )V = 3/2 R ,則 Cp = 5/2 R
Ex 11.3 dU = CV dT 普遍成立嗎?
(只有理想氣體才對,詳見課本)
一個有用的量, adiabatic index (exponent) ,之後會用到
γ = Cp / CV
Ex 11.4 理想氣體的 γ值計算
Ex 11.5 理想氣體的 (i) 單位質量內能與 (ii) 單位體積內能 計算
